
همه نکات کنکوری جدول تناوبی
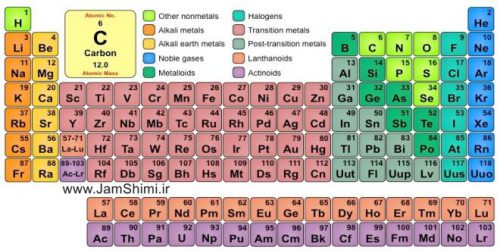
ما در این مطلب می خواهیم برای شما همه نکات کنکوری جدول تنابی را شرح بدهیم .
مشاور تحصیلی تجربی به شما کمک خواهد کرد تا بتوانید به موفقیت برسید
جدول تناوبی عناصر یکی از پایه ای ترین نکات و مهم ترین نکات درس شیمی می باشد. پایه ی مفهومی بسیاری از نکات و مسائل شیمی برگرفته از جدول عناصر یا همان جدول تناوبی مندلیف می باشد. در این مقاله می خواهیم به معرفی نکات مهم جدول تناوبی در شیمی بپردازیم. اگر بتوانید این مطالب را به خوبی درک کنید و از آنها در مسائل و سوالات مفهومی شیمی به خوبی استفاده کنید، بسیاری از سوالات شیمی را فرا گرفته اید چرا که پاییه ای ترین سوالات هستند که پیچیده ترین سوالات را می سازند.
اگر شما پایه شیمی را به خوبی فرا بگیرید ، سپس از پس سوالات سخت و ترکیبی نیز به خوبی بر می آیید. همچنین این نکات به شما کمک خواهند کرد که در آن نوع تست هایی که نکات ریز و انحرافی دارند، باعث می شود که در دام سوالات انحرافی نیفتید و نکات ریز سوالات را به خوبی بتوانید در حل تست به کار بگیرید.
نکات کلی جدول تناوبی:
_ در جدول تناوبی عناصر بر اساس عدد اتمی یا z مرتب شده اند .عدد اتمی برابر است با تعداد پروتون های هسته اتم. بنابراین ایزوتوپ ها در جدول تناوبی از هم جدا نمی شوند. تمام ایزوتوپ های یک اتم در جدول تحلیل یک نام مطرح میشوند.
_ جدول تناوبی دارای ۱۱۸ عنصر است.
_ ۹۴ عنصر اول جدول تناوبی در طبیعت یافت می شوند. بیست و چهار عنصر دیگر یعنی از ۹۵ تا ۱۱۸ در آزمایشگاه ساخته شده اند.
_ از ۹۴ عنصری که در طبیعت یافت می شوند ۸۴ عدد پایدارند. ده عنصر دیگر در طی فرآیند شکست عناصر دیگر به وجود میآیند و ناپایدار می باشند.
_ تاکنون هیچ عنصری سنگین تر است اینستنیم یا همان عنصر ۹۹ در ابعاد مایکروسکوپیک و مقدار زیاد دیده نشده است. عناصر استاتین و فرانسیوم هم تنها به صورت نور ساطع در زیر میکروسکوپ دیده شدهاند.
گروه ها در جدول تناوبی:
_ستون های جدول تناوبی را گروه می نامند.
_ عناصری که در یک گروه قرار دارند دارای خواص شیمیایی مشابه هستند زیر آرایش الکترونی آنها شبیه به هم می باشد یعنی تعداد الکترون های لایه آخر آنها یکسان است.
_ تعداد ۱۸ گروه در جدول تناوبی دارد. شمارهگذاری از سمت چپ به راست می باشد نام و خاص گروهها به ترتیب زیر است( از ستون سمت چپ جدول به راست.):
_گروه یک(فلزات قلیایی):
این گروه یک الکترون در لایه آخر دارند .با از دست دادن یک الکترون به آرایش گازهای نجیب می رسند. بسیار واکنش پذیر بوده .بسیار نرم هستند .در تماس با آب به شدت واکنش داده و محلول بازی تولید می کند.
_گروه دو(فلزات قلیایی خاکی):
دارای دو الکترون در اربیتال بیرونی هستند. واکنش پذیری کمتری نسبت به فلزات قلیایی دارند .سخت تر و چگال تر از فلزات قلیایی هستند.
_گروه سه تا دوازده(عناصر واسطه):
همگی فلز هستند. واکنش پذیری کمتری نسبت به قلیایی خاکی دارند.بینظمیهای زیادی در آرایش الکترونی و خواص آنها دیده می شود.
گروه ۱۳ تا ۱۶:
در این گروهها برخی فلز برخی نافلز و برخی شبه فلز هستند.
گروه ۱۷(هالوژن ها):
این گروه همگی نافلز اند و تنها یک الکترون در لایه آخر کم دارد. به شدت واکنش پذیرند و با فلز های قلیایی تشکیل نمک می دهند. در واکنش با هیدروژن تشکیل اسید می دهند. در حرکت از بالا به پایین در هالوژن ها واکنش پذیری آنها کاهش می یابد زیرا شعاع اتمی آنها زیاد میشود.
گروه ۱۸(گاز های نجیب):
این گروه آرایش الکترونی کاملی دارند تمایل آنها به واکنش کم است.
تناوب در جدول تناوبی:
_ سطر های جدول تناوبی را دوره می نامند.
_ یک دوره جدید زمانی شروع می شود که یک لایه الکترونی اولین الکترون خود را بگیرد .
_جدول تناوبی به چهار دسته تقسیم می شود.
_دسته اول: این دسته شامل فلزات قلیایی، قلیایی خاکی ،هیدروژن و هلیوم می باشد .و آنرا دسته s می نامند. زیرا در تمامی عناصر این دسته آخرین لایه الکترونی s است.
_دسته دوم: این دسته شامل ۶ گروه آخر است. یعنی از گروه ۱۳ تا ۱۸ این دسته را p می نامند در تمامی عناصر این دسته آخرین لایه الکترونیp می باشد.
_دسته سوم: این دسته گروه های ۳ تا ۱۲ را شامل میشود .به این دستهd یا فلزات واسطه میگویند. در تمامی عناصر این دسته آخرین لایه الکترونیd می باشد.
_دسته چهارم: این دسته شامل دو ردیف جدا شده در پایین جدول است ردیف اول را لانتانیدها و رتبه دوم را اکتینید ها می نامند. نام این دسته f است. این دسته شماره گروه ندارد. در تامین آسرین دسته آخرین لایه الکترونیf است.
روند تغییر شعاع اتمی در جدول تناوبی:
شعاع اتمی مستقیماً قابل اندازه گیری نیست. شعاع یک اتم را در مولکول ها اندازه میگیرند و برابر است با نصف فاصله هسته دو اتم در یک مولکول.
_ در یک گروه هرچه از بالا به پایین حرکت کنیم شعاع اتمی افزایش مییابد زیرا تعداد لایه الکترونی افزایش مییابد.
_ در یک دوره از چپ به راست شعاع اتمی کاهش می یابد. زیرا پروتونهای هسته افزایش مییابد اما لایه الکترونی ثابت می باشد.
_ اضافه شدن یک پروتون اثر بیشتری از اضافه شدن یک الکترون دارد در نتیجه کشش هسته بیشتر شده و قطر کاهش میابد.
روند تغییر الکترونگاتیوی در جدول تناوبی:
_الکترونگاتیوی یعنی تمایل یک اتم برای جذب الکترون .
الکترونگاتیوی به صورت نسبی سنجیده میشود. بیشترین الکترونگاتیوی مربوط به فلور است و آن را چهار میگیرند.
_ الکترونگاتیوی سایر عناصر را با توجه به فلوئور تعیین میکنند.
_ در یک گروه هر چه از بالا به پایین حرکت کنیم الکترونگاتیوی اتم ها کاهش می یابد .زیرا فاصله الکترونیک آخر از هسته اتم بیشتر شده و در نتیجه روی آن کمتر است پس از دست دادن این الکترون راحت تر می باشد.
_ در یک دوره از چپ به راست الکترونگاتیوی اتم ها افزایش می یابد زیر لایه آخر کامل تر می شود و در نتیجه گرفتن یک الکترون برای تکمیل کردن لایه آخر آسانتر از دادن الکترون می شود.
_ به طور استثنا گازهای نجیب تمایل به واکنش کمی دارند و کلاً الکترونگاتیوی برای آنها تعریف نمیشود .همچنین لانتانیدها و اکتینید ها هم از دو قانون بالا پیروی نمی کنند.
روند تغیر انرژی یونش در جدول تناوبی:
انرژی یونش مخالف الکترونگاتیوی است. انرژی یونش یعنی میزان انرژی لازم برای جدا کردن یک الکترون از اتم در حالت گازی.
_ در هر گروه با حرکت از بالا به پایین انرژی یونش کاهش می یابد زیرا فاصله آخر الکترون است افزایش یافته و پیوند آن با هسته سست تر میشود.
_ در هر دوره با حرکت از چپ به راست انرژی افزایش مییابد زیرا لایه آخر کامل تر شده و پایدارتر میشود در نتیجه جدا کردن یک الکترون دشوارتر میشود.
_ می توان انرژی جداسازی دومین و سومین الکترون را هم در نظر گرفت .این انرژی را انرژی یونش دوم و سوم می نامند این دو انرژی هم از روندی مشابه انرژی یونش اول پیروی می کنند.
_ به طور استثنا دوره دوم و سوم جدول تناوبی دارای استثنا در مورد انرژی یونش میباشد. بر خلاف قوانین گفته شده روند انرژی یونش در تناوب دوم همواره صعودی نیست.
روند تغییر خاصیت فلزی در جدول تناوبی:
خاصیت فلزی یعنی میزان تمایل اتم برای از دست دادن الکترون.
_ در هر گروه با حرکت از بالا به پایین خاصیت فلزی افزایش مییابد .
_در یک دوره با حرکت از چپ به راست خاصیت فلزی کاهش مییابد.
روند تغییر نقطه ذوب در جدول تناوبی:
نقطه ذوب یعنی دمایی که در آن یک ماده از حالت جامد به مایع در میآید. هرچند پیوند بین اتم ها قوی تر باشد انرژی لازم برای شکستن پیوند بیشتر و نقطه ذوب بالاتر است. روند خاصی در جدول تناوبی برای نقطه ذوب وجود ندارد و قوانین کلی را می توان به دست آورد:
_ فلزات معمولاً نقطه جوش بالایی دارند.
_ بیشتر نافلزات نقطه جوش پایینی دارند.
_ شبه فلز برون بالاترین نقطه جوش را دارد.
راز مهم موفقیت اراده قوی می باشد. اگر شما در یک سال تحصیلی با اراده هر چه تمام تر به تمام نکات برنامه تحصیلی خوب بپردازید به موفقیت نزدیک تر میشوید.
طی این یک ساله آن فردی که با اراده تر و مستحکم تر عمل کند موفقیت بهتری را پیش رو خواهد داشت .همچنین باید این نکته را در نظر داشته باشید که تلاش کردن بدون برنامه آنقدرها موفق عمل نمی کند.
شما باید ابتدا یک برنامه تحصیلی خوب داشته باشید تا بتوانید مانند یک نقشه راه آن را پیموده و به موفقیت برسید. تیم پر قدرت مشاوره تحصیلی استاد محمد موسوی بهترین گزینه برای انتخاب یک مشاور تحصیلی میباشد.
استاد موسوی با ارائه برنامه تحصیلی اختصاصی در قالب پکیج توربو تست و همچنین مشاوره تحصیلی اختصاصی رشته تجربی، هر ساله به دانش آموزان کمک می کند تا به هدف های بالای خود دست یابند.
برای آشنایی بیشتر با تیم استاد محمد موسوی و برنامه جامع توربو تست به صفحه اختصاصی ایشان مراجعه بفرمایید.
برای انتخاب رشته کنکور تجربی نیز می توانید از ما کمک بگیرید




20 دیدگاه دربارهٔ «همه نکات کنکوری جدول تناوبی»
تا اورانیوم در طبیعت یافت می شود عنصر ۹۲
ممنونم از نکات ارزشمندتون، کمککننده و کلیدی بودند!
عالی بود مطالبتون خیلییی ممنون :))❤
الهییی
خواهش میکنم
ممنون کامل نبود
نکاتتون سطحیه و زیاد کامل نیست
از گفتن نکات ریز چشم پوشی شده
در هر ردیف جدول تناوبی چند عنصر وجود داره؟
بستگی به ردیف دارد به ترتیب ردیف ها ۲ ، ۸ ،۸ ،۱۸، ۱۸ ، ۳۲ ، ۳۲
بعضی مطالب کاملا اشتباه بودن
حق میگه
عزیزی شما
نکات مهم و کلیدی به طور خلاصه ♥👍🏼
ممنونم عالی بود
اون شبه فلز که نوشتید ( برون ) بالاترین نقطه ذوب را دارد برون چیه اصلا؟ فک کنم منظئرتئن این بوده که محققان پژوهشگاه Brown این ماده رو کشف کردن
ممونم
شبه فلز بور در زبان لاتین boron نوشته می شود .
✅✅
👌عالی
ممنونم دخترم